Claudio De Felice[1,2], Giulia Moscaritolo[3], Lidia Boasiako[1,2], Marianna Manara[4,5], Valeria Scandurra[6], Roberto Canitano[6], Francesco Strati[7], Silvia Leoncini[1,2]
[1] U.O.C. Terapia Intensiva Neonatale – Policlinico «S. Maria alle Scotte» Azienda Ospedaliera Universitaria Senese (AOUS) – Siena
[2] Centro di Ricerca e Sperimentazione Sindrome di Rett – U.O.C. Neuropsichiatria Infantile – Policlinico «S. Maria alle Scotte» AOUS – Siena
[3] Fit Express – Loc. Belvedere – Colle di Val d’Elsa – Siena 4 Divisione di Neuropsichiatria dell’Infanzia e dell’Adolescenza, Spedali Civili, Università di Brescia – Brescia
[5] Unità di Neuropsichiatria infantile, ASST dei Sette Laghi, Ospedale Filippo del Ponte– Varese [6] U.O.C. Neuropsichiatria Infantile – Policlinico «S. Maria alle Scotte» AOUS – Siena
[7] Laboratory of Mucosal Immunology, Department of Experimental Oncology, European Institute of Oncology – IEO, Milano
Nonostante il coinvolgimento primario del Sistema Nervoso Centrale (SNC), la Sindrome di Rett (RTT) è attualmente riconosciuta come una malattia multi-sistemica (Leoncini et al. 2015, Cronk et al. 2016). La qualità di vita delle pazienti affette dalla Rett è influenzata e/o in parte compromessa da manifestazioni gastrointestinali, quali stipsi (90 %), reflusso gastroesofageo (GERD) e malassorbimento (Motil et al. 2012). Numerosi studi clinici e sperimentali si sono focalizzati sulle alterazioni del microbiota intestinale nella RTT (Strati et al. 2016; Borghi et al. 2017; Strati et al. 2018; Borghi & Vignoli 2019; Neier et al. 2021; Thapa et al. 2021; Gallucci et al. 2021). La disbiosi intestinale nella RTT è associata a ridotta variabilità delle specie batteriche commensali, aumentato numero di specie microbiche/fungine residenti con potenziale patogeno (Candida parapsilosis) e infiammazione intestinale (Strati et al. 2018). È sempre più evidente la coesistenza e l’importanza di una comunicazione bidirezionale tra SNC e sistema nervoso enterico (gut-brain-axis) (Cryan et al. 2019; Silva et al. 2020) che collega centri emozionali e cognitivi alle funzioni periferiche intestinali.
Il microbioma intestinale è essenziale per il normale sviluppo e mantenimento delle funzioni cerebrali. Numerosi studi hanno mostrato evidenze della modulazione del microbiota intestinale in numerose malattie neurologiche, psichiatriche e malattie neurodegenerative (Bashir & Khan 2022). La modulazione della risposta infiammatoria sistemica mediante pre-biotici e pro-biotici è una possibile strategia di approccio terapeutico globale per rallentare il declino cognitivo in malattie neurodegenerative influenzando l’asse intestino-cervello (Li et al. 2021). Inoltre, i pre-biotici possono modificare la composizione del microbiota intestinale stimolando la crescita di alcuni taxa batterici promuovendo lo stato di salute dell’ospite (Vyas et al. 2012). L’uso di pre-biotici potrebbe quindi migliorare la disbiosi intestinale nelle pazienti RTT. L’alfa-lattoalbumina (ALAC) è una proteina ricca di triptofano, abbondante nel colostro umano (Lonnerdal 1985), è risultata efficace in modelli sperimentali (Citraro et al. 2011; Russo et al. 2012) e pazienti con epilessia (Mainardi et al. 2008; Errichiello et al. 2011). ALAC svolge inoltre specifiche azioni intestinali (Lonnerdal 1985; Yamaguchi et al. 2014) e sul processo di sintesi della serotonina, neurotrasmettitore del SNC con nota attività anticonvulsivante (Choi et al. 2011). L’ALAC ha mostrato un miglioramento dell’infiammazione intestinale e un effetto anticonvulsivante in modelli murini sperimentali (De Caro et al. 2019). L’utilizzo di ALAC in pazienti pediatrici con epilessia e disturbi del sonno migliora nel 62.9 % la qualità del sonno (riduzione della latenza e dei risvegli notturni) dopo 3 mesi di trattamento (Esposito et al. 2019). In pazienti pediatrici con emicrania senza aurea, l’impiego di ALAC riduce del 74.3% la frequenza mensile di episodi e 42.2% l’intensità degli episodi critici dopo un mese di trattamento (Ruotolo et al. 2019).
L’acido butirrico (BUT), noto acido grasso a catena corta (SCFA), contribuisce al funzionamento della mucosa intestinale, influenza in modo positivo l’ecosistema del tratto gastro-intestinale e svolge attività antinfiammatoria (Silva et al. 2020). È stato dimostrato l’effetto anticonvulsivante del BUT in modelli sperimentali di epilessia (De Caro et al. 2019), probabilmente attraverso un aumento dei livelli di triptofano e suoi metaboliti (acido chinurenico) che può penetrare nel cervello e agire sui recettori del glutammato (NMDA) (Citraro et al. 2011, Russo et al. 2012). Il BUT agisce direttamente sul cervello modulando numerosi processi fisiologici attraverso recettori e trasportatori specifici con proprietà inibitorie sulle deacetilasi istoniche (HDAC). Livelli fisiologici di BUT possono influenzare indirettamente il cervello (regolazione del sistema immunitario e attività del nervo vago) mentre livelli soprafisiologici esercitano effetti neurofarmacologici facilitando il synaptic tagging e capturing (Stilling et al. 2016). I frutto-oligosaccaridi (FOS) e l’inulina sono fibre non digeribili da
cui si producono gli SCFA. Entrambi svolgono importanti azioni fisiologiche quali anti-carcinogenesi, effetto pre-biotico (stimolazione crescita di microflora intestinale non patogena), riducono i livelli sierici di colesterolo, triacilgliceroli e fosfolipidi (Kelly 2008, Sabater-Molina et al. 2009). Spesso nelle formulazioni pre-biotiche viene incluso l’ossido di zinco che, oltre a essere una fonte di zinco, micronutriente che protegge le cellule dallo stress ossidativo, consente la normale funzione del sistema immunitario diminuendo l’espressione di molecole coinvolte nella risposta infiammatoria e immunitaria.
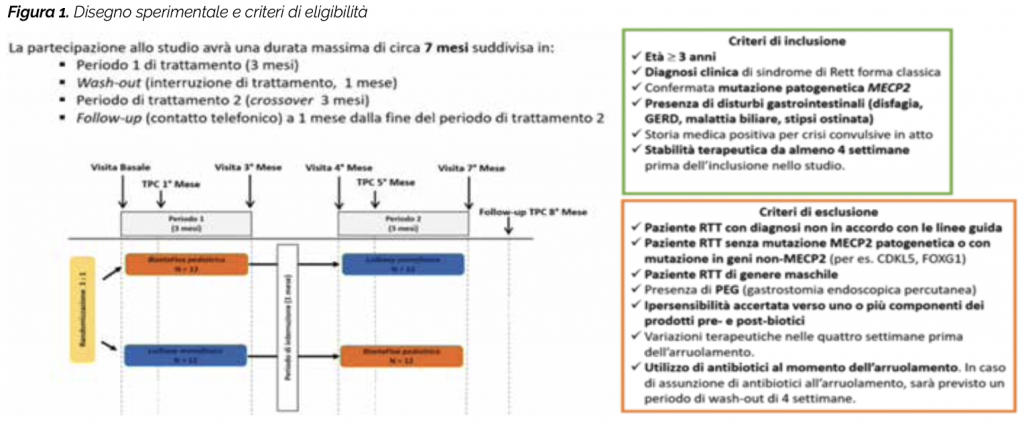
Trial Clinico (ClinicalTrials.gov Iden- tifier: NCT05420805)
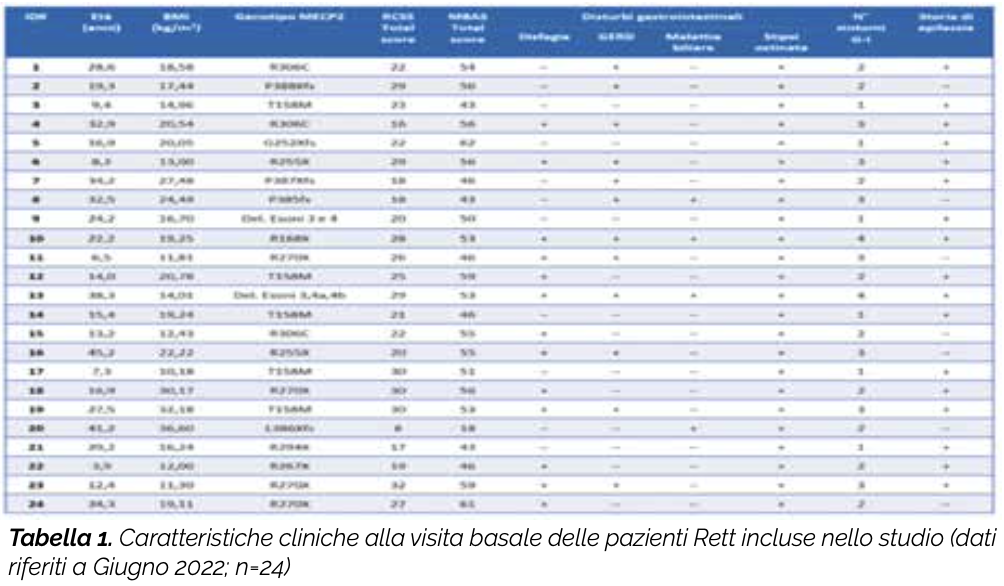
Gli obiettivi del presente Trial clinico sono valutare in una popolazione di pazienti RTT con mutazione patogenetica MECP2 l’effetto di due prodotti contenenti pre- e post-biotici (Lalbaay monofasico e Bizetaflox pediatrico; Kolfarma s.r.l., Italia) su (1) stato infiammatorio e disbiosi intestinale (2) epilettogenesi (frequenza e entità delle crisi convulsive) e (3) gravità clinica e qualità di vita. I principali componenti di Lalbaay monofasico (ALAC, acido butirrico, inulina e frutto-oligosaccaridi FOS), alimento a fini medici speciali utilizzato nel trattamento dietetico delle epilessie farmaco-resistenti, oltre a controllare in modo selettivo la crescita / il metabolismo della flora intestinale e il corretto funzionamento della mucosa intestinale, sono in grado di influenzare la sintesi della serotonina cerebrale, neurotrasmettitore con nota attività anticonvulsivante. BizetaFlox pediatrico è un integratore alimentare a base di acido butirrico (sodio butirrato) e ossido di zinco. L’ossido di zinco è una fonte di zinco, micronutriente che protegge le cellule dallo stress ossidativo e consente la normale funzione del sistema immunitario diminuendo l’espressione di molecole coinvolte nella risposta infiammatoria e immunitaria. L’acido butirrico, oltre a contribuire al corretto funzionamento della mucosa intestinale e a svolgere attività antinfiammatoria, può esercitare effetti positivi antiepilettici. Lo studio è monocentrico (Centro di Ricerca e Sperimentazione Sindrome di Rett e U.O.C. Neuropsichiatria Infantile Policlinico «S. Maria alle Scotte» Azienda Ospedaliera Universitaria Senese – Siena). Il disegno consiste in uno studio randomizzato cross-over con due bracci di trattamento: (1) Lalbaay Monofasico e (2) Bizetaflox Pediatrico. Tutte le pazienti arruolate avranno quindi l’opportunità di ricevere entrambi i prodotti in studio. Ad inizio studio la paziente sarà assegnata casualmente ad uno dei 2 trattamenti (1:1). Non è previsto l’utilizzo di placebo. I criteri di eligibilità sono elencati in Figura 1. Le caratteristiche cliniche individuali alla visita basale delle pazienti RTT arruolate (dati riferiti al mese di Giugno 2022) sono sintetizzate schematicamente in Tabella 1. Per la valutazione dell’accrescimento somato-ponderale saranno utilizzate curve specifiche di accrescimento adattate alla RTT (Tarquinio et al. 2012). Saranno raccolte informazioni su intake nutrizionale e metabolismo basale.
In particolare, informazioni relative alle abitudini alimentari delle pazienti RTT saranno raccolte mediante (1) Questionario su frequenza degli alimenti, (2) Anamnesi alimentare o storia dietetica della paziente (Dwyer 1994) e (3) Diario alimentare strutturato su 7 giorni consecutivi (Thompson e Byers 1994, Buzzard 2002). Il calcolo dell’assunzione di calorie, liquidi, macro- e micronutrienti sarà effettuato mediante l’utilizzo del software WinFood (Medimatica, Teramo, Italia). Gli intake saranno analizzati, confrontati con i LARN (SINU, LARN, 2018) e classificati come “Adeguati” / “Non adeguati”. Per la valutazione del benessere gastrointestinale e della stipsi saranno utilizzati:
– il questionario GHQ (Gastrointestinal Health Questionnaire) (Motil et al. 2021) e la scala Bristol (Bristol stool scale) (Lewis and Heaton 1997). La gravità clinica della malattia sarà valutata mediante l’utilizzo di due scale validate a livello internazionale e già in ampio uso clinico quali la scala RCSS (Rett Clinical Severity Score) (Neul et al. 2008) e la scala MBAS (Motor Behavioural Assessment Scale) (FitzGerald et al. 1990). Lo stato di benessere delle pazienti RTT sarà misurato mediante la somministrazione dei questionari RSBQ (Rett Syndrome Behaviour Questionnaire) (Mount RH et al. 2002), SDSC (Sleep Disturbance Scale for Children) (Bruni et al. 1996) e QI-Disability (Quality of Life Inventory Disability) (Epstein et al. 2019; Downs et al.2019).
Gli esiti dello studio saranno suddivisi in (1) Endpoint primario = Miglioramento dello stato infiammatorio del tratto gastrointestinale (riduzione livelli circolanti di citochine pro-infiammatorie/ aumento delle citochine anti-infiammatorie; riduzione livelli di calprotectina fecale) e della biodiversità (tassonomia/metagenomica) del microbiota intestinale; (2) Endpoint secondario: riduzione frequenza e/o entità delle crisi epilettiche e (3) Endpoint terziario: miglioramento degli indici di benessere [(sonno e qualità della vita (questionari: RSBQ, GHQ, Bristol, QI-Disability, SDSC)] e gravità clinica (MBAS). In prospettiva, il presente disegno sperimentale potrà sperabilmente aggiungere ulteriori conoscenze sulla relazione microbiota intestinale-gravità clinica e delucidare il ruolo della connessione gut-brain-axis nel contesto clinico delle pazienti RTT con particolare riguardo a epilettogenesi, qualità del sonno e comportamento. Inoltre, la possibilità di migliorare l’infiammazione gastrointestinale, la gravità clinica e la qualità di vita attraverso la modulazione del microbiota intestinale mediante l’uso di molecole pre- e post-biotiche apre la strada ad un possibile nuovo approccio terapeutico nella RTT.

