Stress ossidativo e trial clinico randomizzato placebo controllato (Fase 2A) con EPI-743 nella sindrome di Rett
Joussef Hayek – U.O.C. Neuropsichiatria Infantile, Azienda Ospedaliera Universitaria Senese, Siena
Introduzione
Da oltre 5 anni l’interesse principale del nostro gruppo di ricerca è focalizzato sulla valutazione dello stress ossidativo (SO) nella sindrome di Rett (RTT), quale modello di malattia neuro-regressiva all’interno dell’ambito più ampio dei disturbi dello spettro autistico. In particolare, sarebbe di importanza critica la dimostrazione di un rapporto causa-effetto tra deficit funzionale della proteina MeCP2 e sbilanciamento redox. Per questo motivo il nostro team è attualmente impegnato, al fianco di altri team internazionali, nel verificare l’ipotesi dell’esistenza di un danno ossidativo cerebrale in modelli murini della malattia. I risultati dei nostri studi clinici convergono nel suggerire che un’alterazione dell’equilibrio tra fattori pro-ossidanti e sistemi anti-ossidanti è intimamente legato alla patogenesi e alla storia naturale della RTT (Leoncini et al. 2011, Signorini et al. 2011, Pecorelli et al. 2011, De Felice et al. 2011, Grillo et al. 2013, Sticozzi et al. 2013), anche se finora restano da chiarire i meccanismi che legano il deficit della proteina MeCP2 allo SO. Da una prospettiva più generale possiamo concludere che l’eccessivo SO, evidenziabile in liquidi biologici (per es. sangue) e in sistemi cellulari (per es. fibroblasti cutanei in coltura) provenienti da pazienti RTT, deriva principalmente da un’aumentata attività ossidante (legata alla formazione di specie reattive dell’ossigeno, ROS) piuttosto che da un deficit del sistema antiossidante, come invece avviene nell’autismo classico (De Felice et al. 2012a).
 Nella foto C. De Felice e J. Hayek
Nella foto C. De Felice e J. Hayek
Che l’anomalia dell’omeostasi ossidativa in RTT sia presumibilmente un fenomeno complesso è suggerito dal fatto che, almeno nella nostra esperienza, la supplementazione della dieta con anti-ossidanti tradizionali quali la luteina o la melatonina non sembra avere un impatto maggiore sull’evoluzione della malattia. Al contrario, esiste una specie di “paradosso degli acidi grassi” nel senso che la perossidazione di acidi grassi polinsaturi sia ω-6 (per es. acido arachidonico e acido adrenico) che ω-3 (acido eicosapentaenoico e acido docosaesanoico) determina probabilmente il danno ossidativo nella RTT, mentre la somministrazione di acidi grassi polinsaturi ω-3 (gli stessi acidi eicosapentaenoico e docosaesanoico) ha un effetto positivo sulla sintomatologia clinica e forse sull’evoluzione della malattia se somministrati in fase molto precoce (De Felice et al. 2012b).
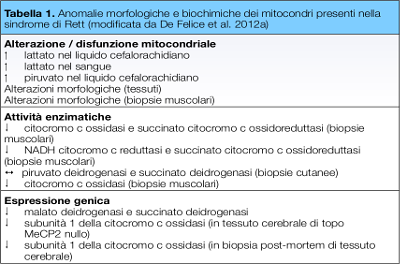
E’ noto che la principale fonte intracellulare di ROS è rappresentata dai mitocondri, le “batterie” che in presenza di ossigeno producono l’energia necessaria per l’attività cellulare (respirazione cellulare). Esistono varie evidenze che indicano che nella RTT esiste una mitocondriopatia aspecifica (forse secondaria) (De Felice et al. 2012a). Infatti nel tempo sono state evidenziate sia anomalie morfologiche che biochimiche nei mitocondri ottenuti da biopsie tessutali di pazienti RTT, anche se finora non ne è chiaro il significato fisio-patologico (Tabella 1).
Tabella 1. Anomalie morfologiche e biochimiche dei mitocondri presenti nella
sindrome di Rett (modificata da De Felice et al. 2012a)
La combinazione di queste informazioni (aumentato SO e anomalie mitocondriali) ci ha quindi portato a testare, in collaborazione con l’Edison Pharmaceuticals, l’efficacia di un nuovo composto di sintesi (EPI-743), finora esclusivamente utilizzato in malattie mitocondriali primitive, quali la sindrome di Leigh, l’atassia di Friedreich, o la neuropatia ottica ereditaria di Leber (Enns et al. 2012, Sadun et al. 2012, Martinelli et al. 2012, Blankenberg et al. 2012, Pastore et al. 2013).
EPI-743
L’EPI-743 è un analogo del para-benzochinone sviluppato all’interno di una nuova classe di farmaci denominati D-BITS (digital biochemical information transfer and sensing compounds). La sostanza è rappresentata da una piccola molecola stabile con ottima biodisponibilità per os, in grado di raggiungere facilmente il sistema nervoso centrale attraverso la barriera emato-encefalica. La molecola si è dimostrata da 1000 a 10000 volte più potente rispetto al Coenzima Q10 (Co Q10) o all’Idebenone (Co Q10 di sintesi) nella protezione delle cellule nei confronti dello SO (Figura 1). Il meccanismo di azione dell’EPI 743 non è ancora noto con precisione anche se si suppone che regoli il controllo metabolico e arricchisca il pool di glutatione ridotto, principale antiossidante intracellulare (Shrader et al. 2011, Sadun et al. 2012).
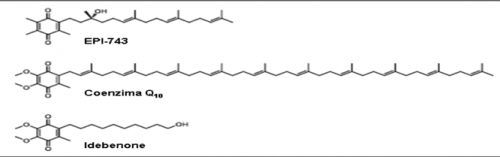
Figura 1
Nei numerosi trial clinici in cui è stato valutato l’EPI-743 ha dimostrato una significativa efficacia terapeutica in varie malattie mitocondriali, (Tabella 2) a fronte di effetti collaterali trascurabili o assenti. La RTT si può considerare la “new entry” fra le patologie in cui l’EPI-743 è attualmente in corso di sperimentazione.
Trial clinico con EPI-743 nella sindrome di Rett
Dopo i primi contatti, l’Edison Pharmaceuticals di Mountain View (CA, USA) ha deciso di assegnare all’U.O.C. di Neuropsichiatria Infantile di Siena il compito di condurre il primo trial randomizzato a livello mondiale per l’EPI-743 nella RTT, sotto la supervisione dell’OPBG Clinical & Research Services di Roma. Lo studio consiste in una valutazione randomizzata, placebo-controllata e in doppio cieco dell’efficacia dell’EPI-743 nella RTT. I principali end-point, insieme ai criteri di inclusione e di esclusione dello studio, della durata complessiva di 6 mesi, sono già stati descritti nel dettaglio su un recente numero della rivista ViviRett. Dopo l’acquisizione delle necessarie autorizzazioni da parte dei Comitati Etici, abbiamo quindi iniziato il trial in soggetti con RTT classica in stadio 2 con dimostrazione di coesistente mutazione del gene MeCP2 (vedi caratteristiche in Tabella 3). Il numero target di soggetti da arruolare era stato inizialmente fissato a 20, anche se in realtà abbiamo arruolato complessivamente 24 soggetti e pur rifiutando numerose richieste dal territorio nazionale e internazionale.
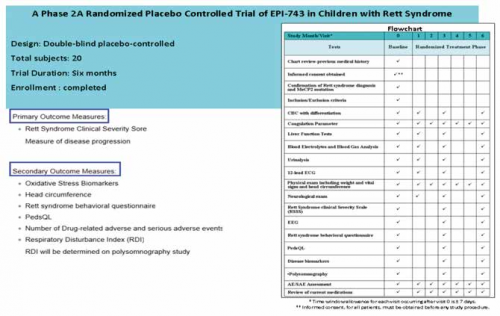
Schema di sperimentazione con EPI 743 nella sindrome di Rett (tratto dal protocollo sperimentale)
Attualmente lo studio è ancora in corso. L’arruolamento delle pazienti è ormai completato e l’assegnazione randomizzata farmaco/placebo è già stata effettuata “in cieco” dall’U.O.C. di Farmacia dell’AOUS di Siena. Finora non sono emersi effetti collaterali nelle pazienti arruolate. Sono anche emerse le inevitabili difficoltà logistiche nel concentrare in relativamente poco tempo un numero consistente di analisi biochimiche non automatizzabili (quali per esempio i dosaggi dei marker di SO) e di numerose valutazioni cliniche ripetute circa a scadenza mensile in pazienti RTT provenienti da tutta la penisola (dalla Val di Non alla Sicilia) e persino dall’estero.
Naturalmente non sarà possibile conoscere il risultato dello studio fino all’apertura del doppio cieco al completamento della sperimentazione, prevista per fine anno 2013. Sarà poi necessaria la fase di valutazione statistica dei dati che richiederà non meno di 2 mesi.
Solamente allora potremo sapere in maniera scientifica se l’EPI-743 potrà essere considerata o meno una nuova arma terapeutica in grado di migliorare la qualità di vita delle pazienti affette dalla RTT e delle loro famiglie e se esisteranno i presupposti per estendere la sperimentazione anche a pazienti ad uno stadio più tardivo della malattia.
Sarà anche interessante sapere se un’eventuale combinazione di EPI-743 e di acidi grassi polinsaturi omega-3 possa risultare più efficace rispetto alle singole molecole.
Ringraziamenti
I miei sinceri ringraziamenti vanno alle bambine Rett e alle loro famiglie che hanno accettato di partecipare al trial clinico; a tutti i miei collaboratori e collaboratrici che stanno eseguendo con la massima attenzione e scrupolosità i compiti relativi ai loro rispettivi ruoli lungo il complesso percorso scientifico della sperimentazione; al personale dell’OPBG Clinical & Research Services che sta monitorando la sperimentazione; a Lucia Dovigo, Presidente dell’Associazione Italiana Rett (AIR); al Direttore Generale dell’AOUS, dott. Pierluigi Tosi, al Direttore Sanitario dell’AOUS, alla dott.ssa Silvia Briani e alla dott.ssa Roberta Croci dell’Ufficio amministrativo dell’AOUS di Siena per il continuo supporto.
Composizione del team di studio EPI-743
Valutazione clinica (U.O.C. Neuropsichiatria Infantile, AOUS, Siena)
- Dr. Joussef Hayek (Principal Investigator, P.I.)
- Dr. Claudio De Felice
- Dr. Roberto Canitano
- Dr. Barbara Montomoli
Preparazioni galeniche (U.O.C. Farmacia, AOUS Siena)
- Dr. Silvano Giorgi (Responsabile della randomizzazione)
Laboratorio di Stress Ossidativo (Dip. Medicina Molecolare e dello Sviluppo, Università degli Studi di Siena)
- Prof. Lucia Ciccoli
- Prof. Cinzia Signorini
- Dr. Silvia Leoncini
- Dr. Alessandra Pecorelli
- Dr. Gloria Zollo
Laboratorio di Fisiopatologia Respiratoria (AOUS Siena)
- Dr. Marcello Rossi
- I.P. Ingrid Iacona
Laboratorio di Patologia Clinica (AOUS Siena)
- Dr. Carlo Scapellato
EEG LAB (AOUS Siena)
- Supervisione del trial clinico (OPBG Clinical & Research Services, Rome, Italy)
- Edison Pharmaceuticals (Mountain View, CA, USA)
- Personale infermieristico (U.O.C. Neuropsichiatria Infantile, AOUS Siena)
BIBLIOGRAFIA
Blankenberg FG, Kinsman SL, Cohen BH, Goris ML, Spicer KM, Perlman SL, Krane EJ, Kheifets V, Thoolen M, Miller G, Enns GM. Brain uptake of Tc99m-HMPAO correlates with clinical response to the novel redox modulating agent EPI-743 in patients with mitochondrial disease. Mol Genet Metab 107(4):690-9; 2012.
De Felice C, Signorini C, Durand T, Oger C, Guy A, Bultel-Poncé V, Galano JM, Ciccoli L, Leoncini S, D’Esposito M, Filosa S, Pecorelli A, Valacchi G, Hayek J. F2-dihomo-isoprostanes as potential early biomarkers of lipid oxidative damage in Rett syndrome. J Lipid Res 52(12):2287-97; 2011.
De Felice C, Signorini C, Leoncini S, Pecorelli A, Durand T, Valacchi G, Ciccoli L, Hayek J. The role of oxidative stress in Rett syndrome: an overview. Ann N Y Acad Sci 1259:121-35; 2012a.
De Felice C, Signorini C, Durand T, Ciccoli L, Leoncini S, D’Esposito M, Filosa S, Oger C, Guy A, Bultel-Poncé V, Galano JM, Pecorelli A, De Felice L, Valacchi G, Hayek J. Partial rescue of Rett syndrome by ω-3 polyunsaturated fatty acids (PUFAs) oil. Genes Nutr 7(3):447-58; 2012b.
Enns GM, Kinsman SL, Perlman SL, Spicer KM, Abdenur JE, Cohen BH, Amagata A, Barnes A, Kheifets V, Shrader WD, Thoolen M, Blankenberg F, Miller G. Initial experience in the treatment of inherited mitochondrial disease with EPI-743. Mol Genet Metab. 2012 Jan;105(1):91-102.
Grillo E, Lo Rizzo C, Bianciardi L, Bizzarri V, Baldassarri M, Spiga O, Furini S, De Felice C, Signorini C, Leoncini S, Pecorelli A, Ciccoli L, Mencarelli MA, Hayek J, Meloni I, Ariani F, Mari F, Renieri A. Revealing the complexity of a monogenic disease: rett syndrome exome sequencing. PLoS One 8(2):e56599; 2013.
Leoncini S, De Felice C, Signorini C, Pecorelli A, Durand T, Valacchi G, Ciccoli L, Hayek J. Oxidative stress in Rett syndrome: natural history, genotype, and variants. Redox Rep 16(4):145-53; 2011.
Martinelli D, Catteruccia M, Piemonte F, Pastore A, Tozzi G, Dionisi-Vici C, Pontrelli G, Corsetti T, Livadiotti S, Kheifets V, Hinman A, Shrader WD, Thoolen M, Klein MB, Bertini E, Miller G. EPI-743 reverses the progression of the pediatric mitochondrial disease-genetically defined Leigh Syndrome. Mol Genet Metab 107(3):383-8; 2012.
Pastore A, Petrillo S, Tozzi G, Carrozzo R, Martinelli D, Dionisi-Vici C, Di Giovamberardino G, Ceravolo F, Klein MB, Miller G, Enns GM, Bertini E, Piemonte F. Glutathione: A redox signature in monitoring EPI-743 therapy in children with mitochondrial encephalomyopathies. Mol Genet Metab 109(2):208-14; 2013.
Pecorelli A, Ciccoli L, Signorini C, Leoncini S, Giardini A, D’Esposito M, Filosa S, Hayek J, De Felice C, Valacchi G. Increased levels of 4HNE-protein plasma adducts in Rett syndrome. Clin Biochem 44(5-6):368-71; 2011.
Sadun AA, Chicani CF, Ross-Cisneros FN, Barboni P, Thoolen M, Shrader WD, Kubis K, Carelli V, Miller G. Effect of EPI-743 on the clinical course of the mitochondrial disease Leber hereditary optic neuropathy. Arch Neurol 69(3):331-8; 2012.
Shrader WD, Amagata A, Barnes A, Enns GM, Hinman A, Jankowski O, Kheifets V, Komatsuzaki R, Lee E, Mollard P, Murase K, Sadun AA, Thoolen M, Wesson K, Miller G. α-Tocotrienol quinone modulates oxidative stress response and the biochemistry of aging. Bioorg Med Chem Lett 21(12):3693-8; 2011.
Signorini C, De Felice C, Leoncini S, Giardini A, D’Esposito M, Filosa S, Della Ragione F, Rossi M, Pecorelli A, Valacchi G, Ciccoli L, Hayek J. F-neuroprostanes mediate neurological severity in Rett syndrome. Clin Chim Acta 412(15-16):1399-406; 2011.
Sticozzi C, Belmonte G, Pecorelli A, Cervellati F, Leoncini S, Signorini C, Ciccoli L, De Felice C, Hayek J, Valacchi G. Scavenger receptor B1 post-translational modifications in Rett syndrome. FEBS Lett. 2013 doi:pii: S0014-5793(13)00396-7 (in fase di pubblicazione).