La tossina, studiata per il ruolo che essa ricopre come fattore di virulenza, si è rivelata in grado di promuovere la plasticità nervosa e di proteggere le cellule dai processi degenerativi tanto in animali sani quanto in modelli di malattia
Bianca De Filippis e Giovanni Laviola – Istituto superiore di sanità Roma
1) Cosa sono le Rho GTPasi e in che modo si collegano alla sindrome di Rett (RTT)?
Le Rho GTPasi sono proteine espresse in modo ubiquitario nelle cellule eucariotiche che agiscono da interruttori in diversi tipi di trasmissione del segnale. Fra le numerose funzioni svolte dalle RhoGTPasi, di particolare interesse è il ruolo fondamentale che esse svolgono nel mediare i cambiamenti strutturali e morfologici neuronali, la connettività e la funzionalità della glia in seguito a stimoli esterni.
Dato il ruolo chiave svolto da questa famiglia di proteine nel controllare la plasticità neuronale, è plausibile che anomalie nel loro funzionamento possano essere almeno in parte responsabili della ridotta plasticità sinaptica che caratterizza la RTT. Ci siamo quindi chiesti se un intervento farmacologico che agisse a livello delle RhoGTPasi, potesse rivelarsi la giusta strategia per contrastare, almeno in parte, la sintomatologia RTT.
A sostegno di questa ipotesi è il fatto che molte forme di disabilità intellettiva non sindromica sono caratterizzate da anomalie morfologiche neuronali, in particolare nei dendriti e nelle spine, che sono note essere associate ad alterazioni del funzionamento delle RhoGTPasi.
2) Cos’è il CNF1?
Il CNF1 è una proteina prodotta da diversi ceppi del batterio Escherichia coli che è stata identificata nel 1983 nei laboratori dell’Istituto Superiore di Sanità (Roma). Inizialmente studiata per il ruolo che essa ricopre come fattore di virulenza, oggi a destare particolare interesse per questa tossina è la sua ormai conclamata capacità di attivare, selettivamente e permanentemente, le GTPasi della famiglia Rho e di favorire la plasticità cerebrale. Tale tossina si è rivelata infatti in grado di promuovere la plasticità nervosa e di proteggere le cellule dai processi degenerativi tanto in animali sani quanto in modelli di malattia.
In particolare, in linea con la letteratura disponibile sulle funzioni svolte dalle RhoGTPasi, in uno studio pubblicato nel 2007, la somministrazione intracerebroventricolare (icv) di questa proteina è stata riportata indurre un miglioramento nell’apprendimento e nella memoria e stimolare la plasticità sinaptica in topi non mutanti. Questi effetti sembrerebbero persistere per settimane, dopo una singola somministrazione di CNF1, ed essere strettamente dipendenti dall’attivazione delle RhoGTPasi.
3) Il CNF1 come potenziale cura per la sindrome di Rett
Per verificare la potenziale efficacia del CNF1 nel contrastare alcuni dei sintomi caratteristici della RTT ci siamo quindi avvalsi di un modello murino per la RTT (Mecp2-308) in una fase pienamente sintomatica (10 mesi di età). Sfruttando la conoscenza approfondita del fenotipo comportamentale da noi acquisita in precedenza, abbiamo quindi valutato se una singola somministrazione intracerebrale di CNF1 fosse in grado di correggere o compensare almeno le alterazioni comportamentali presenti in questo modello di topo transgenico per la RTT, che si ritiene siano riconducibili ai sintomi mostrati dalle pazienti.
3a. Il comportamento
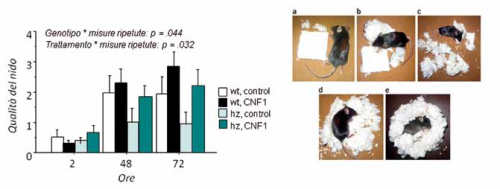 Figura 1. Il trattamento con CNF1 ad uno stadio avanzato della patologia migliora l’abilità di costruzione e quindi la qualità del nido nei topi RTT. La qualità del nido ottenuto è stata valutata mediante una scala di votazione [da 1 (scadente, es. pannelli b e c) a 4 (ottimo, es. pannello e)] dopo 2, 48 e 72 ore a seguito dell’introduzione del materiale da nido nelle gabbiette. hz: topi RTT; wt: topi di controllo. Nel grafico sono rappresentate medie ± SEM.
Figura 1. Il trattamento con CNF1 ad uno stadio avanzato della patologia migliora l’abilità di costruzione e quindi la qualità del nido nei topi RTT. La qualità del nido ottenuto è stata valutata mediante una scala di votazione [da 1 (scadente, es. pannelli b e c) a 4 (ottimo, es. pannello e)] dopo 2, 48 e 72 ore a seguito dell’introduzione del materiale da nido nelle gabbiette. hz: topi RTT; wt: topi di controllo. Nel grafico sono rappresentate medie ± SEM.
I risultati del nostro studio hanno evidenziato, a distanza di numerose settimane da una singola somministrazione della tossina, un significativo miglioramento in diversi domini comportamentali. Il trattamento con CNF1 ha infatti significativamente migliorato la coordinazione motoria dei topi mutanti: l’incapacità dei topi RTT di manipolare in modo efficiente il materiale per la costruzione del nido è stata efficacemente migliorata (Figura 1). Tale deficit era già stato riportato in letteratura in questo modello per la RTT ed è considerato come riconducibile alla aprassia delle mani spesso osservabile nelle pazienti. Inoltre, le anomalie nei livelli generali di attività locomotoria circadiana, mostrate nel corso delle 24 ore, ed in particolare la caratteristica ipoattività espressa dai topi RTT nella fase buia del ciclo (fase in cui i topi, ricordiamo animali notturni, sono principalmente più attivi), sono state efficacemente contrastate dal trattamento con CNF1. Oltre ad esercitare effetti benefici sulle capacità motorie, il CNF1 ha determinato una significativa influenza nel contrastare i deficit di abilità cognitive presenti nel modello per la RTT, misurate mediante il test del fear-conditioning.
3b. La neurobiologia
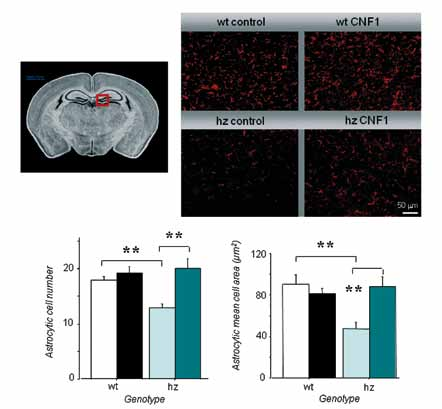 Figura 2. La riduzione nel numero di cellule astrocitarie e l’atrofia a livello di queste popolazioni cellulari presenti nel topo RTT, appaiono contrastate in modo drammatico e persistente nel tempo a seguito del trattamento con CNF1. hz: topi RTT; wt: topi di controllo. * p< .05, ** p < .01 rispetto ai relativi gruppi di controllo.
Figura 2. La riduzione nel numero di cellule astrocitarie e l’atrofia a livello di queste popolazioni cellulari presenti nel topo RTT, appaiono contrastate in modo drammatico e persistente nel tempo a seguito del trattamento con CNF1. hz: topi RTT; wt: topi di controllo. * p< .05, ** p < .01 rispetto ai relativi gruppi di controllo.
La valutazione del ruolo degli astrociti ha avuto recentemente un ampio sviluppo nello studio della eziopatogenesi della sindrome di Rett (per ulteriori informazioni si veda il fascicolo Vivirett n. 59/2011, pp.23-25). In questo ambito, il nostro studio ha permesso di evidenziare una diminuzione nel numero e una marcata atrofia degli astrociti nei topi RTT a livello del corpo calloso e dell’ippocampo. Tali alterazioni di base hanno subito un drammatico miglioramento in seguito a trattamento con CNF1 (Figura 2).
3c. Il metabolismo cerebrale
L’impiego di una metodica di indagine raffinata come l’imaging e la spettroscopia a risonanza magnetica (MRS) ci ha permesso di misurare in maniera assolutamente non invasiva i livelli di metabolismo in diverse aree cerebrali nei topi RTT e di valutare l’eventuale efficacia dell’approccio terapeutico adottato. Tale analisi ha individuato, in linea con i dati della neurobiologia, alterazioni nei livelli dei principali marcatori metabolici dello stato di salute funzionale della glia nei topi RTT, principalmente nell’area striatale.
Il nostro studio ha inoltre rivelato un signicativo incremento di numerosi metaboliti cerebrali, è utile ricordare tuttora presenti a distanza di numerose settimane dal trattamento con CNF1. In particolare, ad essere aumentati sono i metaboliti considerati indice di efficiente funzionalità gliale (in particolare degli astrociti) e di aumentata disponibilità energetica.
 Il dottor Giovanni Laviola durante il suo intervento
Il dottor Giovanni Laviola durante il suo intervento
Conclusioni
I nostri risultati suggeriscono che alcuni dei sintomi caratteristici della sindrome possano essere efficacemente contrastati dalla modulazione farmacologica delle RhoGTPasi. Queste proteine responsabili della plasticità cellulare vengono identificate quindi come un promettente target innovativo per la terapia e la diagnostica della patologia. Il CNF1 sembrerebbe quindi rappresentare un possibile agente farmacologico utilizzabile per contrastare la grave sintomatologia che colpisce le pazienti in una fase avanzata della sindrome.
Quello che a nostro avviso rende questi dati particolarmente interessanti è che mediante una singola somministrazione di CNF1 è stato possibile revertire/compensare alcuni dei sintomi nel topo RTT in modo persistente. La remissione dei deficit era infatti ancora evidente a distanza di 5 mesi dalla somministrazione. Tale dato è particolarmente intrigante se si tiene conto del fatto che il topo in genere ha una aspettativa di vita di meno di due anni.
Data l’estrema complessità del quadro clinico e l’assenza di terapie mirate, anche effetti solamente parziali del CNF1 sulla sintomatologia RTT sembrano di particolare rilevanza. Inoltre, poiché il CNF1 modula l’attivazione biochimica della famiglia delle RhoGTPasi il cui coinvolgimento nelle sindromi di disabilità intellettiva su base genetica è ben noto, l’evidenza di possibili effetti terapeutici potrebbe essere estesa ad altre sindromi di disordini del neurosviluppo. Di nota rimane comunque il fatto che nel modello animale la tossina è stata somministrata direttamente a livello cerebrale. Sebbene siano attivamente in corso studi volti alla identificazione di strategie alternative di somministrazione, magari periferica, ancora molta strada deve essere percorsa in questa direzione prima che questo potenziale approccio terapeutico possa essere valutato per la clinica.

