Laura Vergani – Sezione di Fisiologia, Dipartimento di Scienze della Terra, dell’Ambiente e della Vita, Università degli Studi di Genova
Introduzione
La Sindrome di Rett (RTT, MIM 312750) è un disturbo progressivo dello sviluppo neurologico che colpisce prevalentemente il sesso femminile. Il 95-97% delle RTT con fenotipo classico ed il 50-70% delle varianti presenta mutazioni nel gene MECP2, che mappa in Xq28 e codifica per la metil-CpG binding protein 2, un regolatore trascrizionale altamente espresso nel cervello [Neul et al., 2010]. Nelle bambine RTT con epilessia precoce sono frequenti mutazioni in CDKL5, che mappa in Xp22 e codifica per una serin-treonin chinasi che regola, seppure indirettamente, MeCP2 [Russo et al. 2009]. Sono state anche riportate mutazioni a carico di un terzo gene, FOXG1, che mappa in 14q12 e codifica per un repressore trascrizionale encefalo-specifico. Comunque, per un 3-5% di RTT classiche e 30-50% di RTT varianti non sono state osservate mutazioni in nessuno di questi geni.
Negli ultimi anni si è tentato di correlare l’eterogeneità del quadro clinico, variabile in termini di gravità, età di comparsa e regressione dei sintomi, con il tipo di gene e di mutazione, ma tale correlazione mostra ancora punti controversi [Scala et al. 2007; Bebbington et al. 2008]. Pertanto è stato ipotizzato che differenze a livello di altri parametri, quali lo stress ossidativo, intervengano nel modulare la gravità della patologia [De Felice et al. 2012]. Lo stress ossidativo è una condizione patologica causata dalla rottura dell’equilibrio fisiologico fra produzione/eliminazione di specie chimiche ossidanti. Tra i più comuni ossidanti ricordiamo i radicali liberi, ossia molecole/atomi estremamente reattivi che innescano reazioni a catena danneggiando le strutture cellulari, e le specie reattive dell’ossigeno (ROS). Gli organismi presentano due classi di sistemi di difesa dagli agenti ossidanti: (i) gli antiossidanti enzimatici (Superossido Dismutasi-SOD, catalasi-CAT, Glutatione Perossidasi-GPx); (ii) gli antiossidanti non-enzimatici quali glutatione (GSH) e metallotioneine (MT). è noto che il sistema nervoso è estremamente sensibile agli agenti ossidanti a causa dell’elevato consumo di ossigeno, dei bassi livelli di antiossidanti enzimatici e dell’alta concentrazione di acidi grassi polinsaturi (PUFA) nelle membrane dei neuroni.
Negli ultimi anni, vari lavori hanno evidenziato come una condizione di stress ossidativo caratterizzi la sindrome di Rett [Sierra et al., 2001, Battisti et al., 2004, De Felice et al., 2009]. In particolare, a livello ematico si sono valutati l’attività di alcuni enzimi antiossidanti (SOD, catalasi) [Sierra et al., 2001], il livello di perossidazione lipidica e di marker di stress ossidativo [De Felice 2011] nei pazienti RTT rispetto al gruppo di controllo (soggetti normali sani).
A tale riguardo, la nostra ipotesi è che le metallotioneine, che rappresentano il principale meccanismo antiossidante non enzimatico a livello cellulare insieme al GSH, possano essere un marker accurato e sensibile della condizione di stress ossidativo ematico associato alla sindrome di Rett. Le MT sono proteine a basso peso molecolare (6-7 kDa), caratterizzate da un’alta affinità per i metalli [Coyle et al., 2002]. Sono pressoché ubiquitarie negli organismi e ben conservate attraverso la scala evolutiva, a riprova della loro importanza nei processi biologici [Vergani in ‘‘Metallothioneins and Related Chelators’’, 2009]. La funzione primaria svolta dalle MT è quella di deposito/distributore di zinco all’interno della cellula, e dell’organismo in generale, di protezione da metalli pesanti [Vergani et al. 2007], ma agiscono anche nella difesa dei tessuti dal danno ossidativo [Lanza et al 2009; Vergani et al 2005]. Nell’uomo sono state identificate al momento 17 isoforme, e quelle maggiormente espresse nella maggioranza dei tipi cellulari sono MT-1A, MT-1E e MT-2A. Studi recenti hanno mostrato come le MT siano coinvolte in diverse malattie del sistema nervoso centrale, ad esempio in patologie neurodegenerative quali morbo di Alzheimer, morbo di Parkinson, Sclerosi Multipla e Sclerosi Laterale Amiotrofica [Lanza et al., 2009; Penkowa et al.; 2009; Vergani et al., 2011; Uccelli et al. 2012; Giunti et al. 2012].
Alla luce dello sbilanciamento ossidativo osservato nelle pazienti RTT, rilevabile anche a livello del sangue periferico, il nostro studio ha analizzato l’espressione di tre principali isoforme di MT e l’eventuale correlazione con la condizione di stress ossidativo ematico in una coorte di 27 bambine RTT rispetto a bambine sane omogenee per età e numero.
Materiali e Metodi
Lo studio ha coinvolto due gruppi sperimentali: (i) 27 bambine RTT di età <12 anni (età media 6.8±2.9 anni); (ii) 27 bambine di controllo di età omogenea (età media 6.7±3.2 anni). Tutte le pazienti reclutate nello studio presentano mutazioni nel gene MECP2 e sono state arruolate dall’Unità di Neuropsichiatria Infantile dell’Istituto G. Gaslini di Genova, dal Centro Malattie Metaboliche Rare del Policlinico di Catania, dall’Unità di Pediatria e Neuropsichiatria dell’Ospedale San Paolo di Milano, dall’ambulatorio di Genetica Medica dell’Istituto Auxologico Italiano di Milano, dove è stata anche effettuata la diagnosi molecolare delle pazienti.
Campioni di sangue (2-5 ml) sono stati prelevati, in accordo con la Declaratoria di Helsinki rivista nel 1996, da bambine affette da sindrome di Rett diagnosticata sulla base dei criteri stabiliti dalla European Society of Paedriatic Neurology nel 2001 e da un gruppo di soggetti sani di riferimento della stessa età considerati come controlli. Si è verificato che nessun soggetto inserito nei gruppi di studio sia affetto da malattie genetiche o metaboliche, da malattie sistemiche croniche o infiammatorie.
I campioni di sangue raccolti in tubi contenenti appropriati anticoagulanti sono stati processati tramite centrifugazione su gradiente Ficoll-Hypaque (Histopaque®-1077) per separare le diverse frazioni: plasma, eritrociti (RBC) e globuli bianchi (WBC). I RBC sono stati risospesi in soluzione salina fisiologica, lavati ed infine lisati per shock osmotico. I WBC sono stati risospesi in Trizol ed utilizzati per l’estrazione dell’RNA secondo procedura standard [Chomczynski & Sacchi, 1987]. Le frazioni sono state conservate a -80°C fino al momento dell’uso.
Analisi a livello dei WBC:
l’RNA estratto dai WBC quantificato spettrofotometricamente e controllato su gel di agarosio è stato retrotrascritto in presenza di Trascrittasi inversa (MULV, Fermentas), ed il cDNA utilizzato in una reazione di real-time RT-PCR in presenza di iTaq SYBR Green Supermix with Rox (Biorad, Milano Italia). Per amplificare i trascritti delle varie isoforme di MT si sono utilizzate sonde disegnate ad hoc e sintetizzate dalla TibMolBiol (Genova, Italia). Come controllo positivo è stata amplificata la gliceraldeide 3-fosfato deidrogenasi (GAPDH), tipico gene housekeeping. L’analisi è stata effettuata tramite l’apparecchio Chromo 4™ System real-time PCR della Biorad. Il pattern di trascrizione delle 3 principali isoforme MT-1A, MT-1E e MT-2A ottenuto da campioni di sangue di pazienti Rett è stato confrontato con quelli ottenuti da campioni di soggetti sani.
Analisi a livello dei RBC:
in parallelo all’analisi trascrizionale è stato valutato sul lisato di eritrociti lo stato ossidativo totale (TAR) in termini di produzione di malondialdeide (MDA), un prodotto secondario della reazione di perossidazione lipidica, tramite determinazione spettrofotometrica dei livelli di TBARS (TBA reactive substances) [Iguchi et al., 1993], e l’attività di alcuni importanti enzimi antiossidanti (SOD, Catalasi, GPX) tramite saggi spettrofotometrici. Per le analisi spettrofotometriche si è usato uno spettrofotometro Varian Cary 50 (Varian, Torino Italia) dotato di sistema di termostatazione.
Elaborazione dati e analisi statistica:
L’analisi statistica dei dati è stata effettuata utilizzando il tramite test non parametrico di Wilcoxon-Mann-Whitney.
Risultati
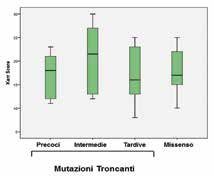
Innanzitutto si è provveduto a classificare le mutazioni di MECP2 esibite dalle bambine RTT in: troncanti precoci (perdita del dominio TRD e/o MBD); troncanti intermedie; troncanti tardive (perdita della regione C-terminale); missenso.
In Tabella 1 e Figura 1 viene riportato lo score clinico medio (± SD) valutato tramite la scala di Kerr per i gruppi di mutazioni analizzate.
Tabella 1
| Mutazioni in MECP2 |
Score Clinico |
| Troncanti Tardive |
17±6.4 |
| Troncanti Precoci+ Intemedie |
19±6.2 |
| Missenso |
18±5.2 |
Si osserva che, come noto, le mutazioni precoci e intermedie sono associate ad un decorso clinico più severo, rispetto alle tardive ed alle missenso.
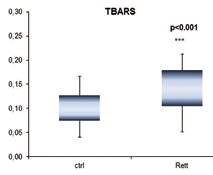
La misura dello stress ossidativo ematico è stata eseguita misurando la perossidazione lipidica e l’attività degli enzimi antiossidanti. In figura 2 è riportato il grafico box-plot che mostra come il livello di TBARS nel gruppo Rett sia significativamente superiore (p<0.001) rispetto a quanto misurato nel gruppo di controllo.
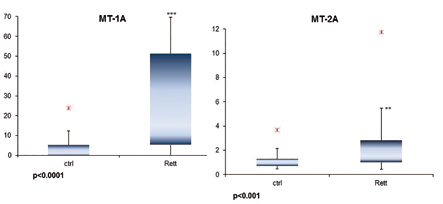
In figura 3 viene riportata l’espressione relativa di due isoforme di MT che risultano significativamente più espresse nel gruppo Rett rispetto al gruppo di controllo.
Conclusioni
Analizzando una coorte di 27 bambine RTT di età < 12 anni rispetto ad altrettante bambine sane si è osservato che a livello del sangue periferico le bambine RTT presentano una condizione di stress ossidativo (quantificato in termini di incremento della perossidazione lipidica negli eritrociti) superiore rispetto alle bambine di controllo. Inoltre le bambine RTT hanno livelli di espressione di MT1A e MT-2A significativamente superiori ai controlli.
Alla luce di questi risultati, le metallotioneine, MT-1A in particolare, potrebbero rappresentare un marker accurato e sensibile di stress ossidativo nella sindrome di Rett rilevabile a livello ematico. Questo parametro molecolare potrebbe essere impiegato per valutare l’efficacia di nuovi approcci terapeutici basati sulla modulazione dello stress ossidativo mirati a rallentare la progressione naturale della malattia, con un mantenimento più duraturo delle autonomie motorie e comunicative, un rallentamento della perdita delle funzioni ed eventualmente un miglioramento delle condizioni cliniche generali.
BIBLIOGRAFIA
Battisti C, Formichi P, Tripodi SA, Meloni I, Mangiavacchi P, Zappella M, Federico A. Lymphoblastoid cell lines of Rett syndrome patients exposed to oxidative-stress-induced apoptosis. Brain Dev. 2004 Sep;26(6):384-8.
Bebbington A, Anderson A, Ravine D, Fyfe S, Pineda M, de Klerk N, Ben-Zeev B, Yatawara N, Percy A, Kaufmann WE, Leonard H. Investigating genotype-phenotype relationships in Rett syndrome using an international data set. Neurology. 2008 Mar 11;70(11):868-75.
Chomczynski, P. and Sacchi, N. (1987). Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry, 162,156-159.
Coyle, P., Philcox, J.C., Carey, L.C., Rofe, A.M. (2002). Metallothionein: the multipurpose protein. Cellular Molecular Life Science, 59,627-637.
De Felice C, Ciccoli L, Leoncini S, Signorini C, Rossi M, Vannuccini L, Guazzi G, Latini G, Comporti M, Valacchi G, Hayek J. Systemic oxidative stress in classic Rett syndrome. Free Radic Biol Med. 2009 Aug 15;47(4):440-8.
De Felice C, Signorini C, Durand T, Oger C, Guy A, Bultel-Poncé V, Galano JM, Ciccoli L, Leoncini S, D’Esposito M, Filosa S, Pecorelli A, Valacchi G, Hayek J. F2-dihomo-isoprostanes as potential early biomarkers of lipid oxidative damage in Rett syndrome. J Lipid Res. 2011 Dec;52(12):2287-97
De Felice C, Signorini C, Leoncini S, Pecorelli A, Durand T, Valacchi G, Ciccoli L, Hayek J. The role of oxidative stress in Rett syndrome: an overview. Ann N Y Acad Sci. 2012 Jul;1259:121-35.
Giunti D., B. Parodi, C. Usai, L. Vergani, S. Casazza, S. Bruzzone, G. Mancardi, A.Uccelli “Mesenchymal Stem Cells Shape Microglia Effector Functions Through the Release of CX3CL1” Stem Cells Sep;30(9), pp. 2044-53, 2012
Iguchi H, Kojo S, Ikeda M.Lipid peroxidation and disintegration of the cell membrane. J Appl Toxicol 1993 13, 269,
James, S.J., Cutler, P., Melnyk, S., et al. (2004). Metabolic biomarkers of increased oxidative stress and impaired methylation capacity in children with autism. American Journal of Clinical Nutrition, 80,1611-1617.
Lanza, C., Morando, S., Voci, A., et al. (2009). Neuroprotective mesenchymal stem cells are endowed with a potent antioxidant effect in vivo. Journal Neurochemistry, 110,1674-1684.
Neul JL, Fang P, Barrish J, Lane J, Caeg EB, Smith EO, Zoghbi H, Percy A, Glaze DG. Specific mutations in methyl-CpG-binding protein 2 confer different severity in Rett syndrome. Neurology. 2008 Apr 15;70(16):1313-21.
Penkowa, M., Sorensen, B.L,, Nielsen, S.L., Hansen, P.B. (2009). Metallothionein as a useful marker in Hodgkin lymphoma subclassification. Leukemia and Lymphoma, 50,200-210.
Russo S, Marchi M, Cogliati F, Bonati MT, Pintaudi M, Veneselli E, Saletti V, Balestrini M, Ben-Zeev B, Larizza L. Novel mutations in the CDKL5 gene, predicted effects and associated phenotypes. Neurogenetics. 2009 Jul;10(3):241-50.
Scala E, Longo I, Ottimo F, Speciale C, Sampieri K, Katzaki E, Artuso R, Mencarelli MA, D’Ambrogio T, Vonella G, Zappella M, Hayek G, Battaglia A, Mari F, Renieri A, Ariani F.MECP2 deletions and genotype-phenotype correlation in Rett syndrome. Am J Med Genet A. 2007 Dec 1;143A(23):2775-84
Sierra C, Vilaseca MA, Brandi N, Artuch R, Mira A, Nieto M, Pineda M.Oxidative stress in Rett syndrome. Brain Dev. 2001 Dec;23 Suppl 1:S236-9.
A. Uccelli, M. Milanese, MC. Principato, S. Morando, Bonifacino T., L. Vergani, D. Giunti, A. Voci, E. Carminati, F. Giribaldi, C. Caponnetto and GB Bonanno “Intravenous Mesenchymal Stem Cells Improve Survival and Motor Function in Experimental Amyotrophic Lateral Sclerosis” Molecular Medicine, Jul 18;18, pp.794-80 2012
Uchida, Y., Takio, K., Titani, K., Ihara, Y., Tomonaga, M. (1991). The growth inhibitory factor that is deficient in the Alzheimer’s disease brain is a 68 amino acid metallothionein-like protein. Neuron, 7,337-347.
Vergani L, Grattarola M, Borghi C, Dondero F, Viarengo A.Fish and molluscan metallothioneins. FEBS J. 2005 Dec;272(23):6014-2
Vergani L., Lanza C., Borghi C., Scarabelli L., Panfoli I., Burlando B., Viarengo A., Gallo G. “Effects of growth hormone and cadmium on the transcription regulation of two metallothionein isoforms” Molecular and Cellular Endocrinology 2007 Jan,15;263(1-2), 29-37
Vergani L. “Metallothioneins in aquatic organisms: fish, crustaceans, molluscs and echinoderms” in Metal ions in life sciences Vol 5 (eds A. Sigel, H. Sigel, and R.K.O. Sigel), Royal Society of Chemistry Publishing, Cambridge, UK, ISSN 1559-0836, 199-233 2009
Vergani L., Lanza C, Rivaro P, Abelmoschi M, Genti S, Veneselli E, Minniti G, Grasselli E, Canesi L, Voci A “Metals, metallothioneins and oxidative stress in blood of autistic children” Research in Autism Spectrum Disorders 2011