Un nuovo studio individua difetti morfologici significativi a carico delle connessioni nervose durante una fase molto precoce dello sviluppo nel topo Mecp2-KO.
A cura di Elena M. Boggio1 e Maurizio Giustetto2
1CNR, Neuroscience Institute Pisa, Pisa; 2Università di Torino e Istituto Nazionale di Neuroscienze,Torino
Le sinapsi sono i punti di contatto utilizzati dai neuroni, le cellule del sistema nervoso centrale, per comunicare fra loro. Sono costituite da una struttura presinaptica – la terminazione assonale – che è parte del neurone che invia le informazioni, e da una specializzazione postsinaptica che si trova sul neurone ricevente. Le sinapsi possiedono proprietà eccitatorie o inibitorie a seconda che stimolino o reprimano, rispettivamente, l’attività del neurone ricevente.
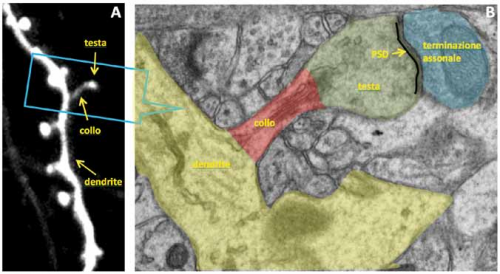 Fig. 1. Segmento di dendrite e spine visualizzati attraverso il microscopio confocale (A) ed il microscopio elettronico (B). Con entrambi i microscopi si possono distinguere il dendrite, il collo e la testa della spina ma solamente con il microscopio elettronico è possibile visualizzare strutture come la densità postsinaptica (PSD) e le vescicole sinaptiche nella terminazione
Fig. 1. Segmento di dendrite e spine visualizzati attraverso il microscopio confocale (A) ed il microscopio elettronico (B). Con entrambi i microscopi si possono distinguere il dendrite, il collo e la testa della spina ma solamente con il microscopio elettronico è possibile visualizzare strutture come la densità postsinaptica (PSD) e le vescicole sinaptiche nella terminazione
Nella corteccia cerebrale la stragrande maggioranza delle terminazioni assonali dei neuroni eccitatori (circa il 90%) formano sinapsi sulle spine dendritiche (SD), sporgenze specializzate che emergono dal dendrite (Fig. 1) ovvero quel tipo di prolungamento della cellula neuronale che si trova organizzato in strutture ramificate (Fig. 2A).
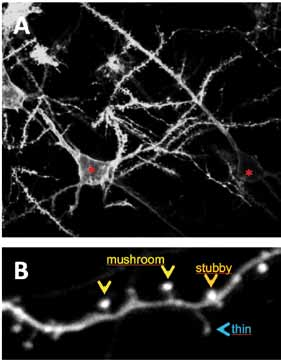 Fig. 2 Esempi di neuroni della corteccia cerebrale: si possono distinguere i corpi cellulari (asterisco) da cui emerge il dendrite principa le che si ramifica in dendriti secondari. I dendriti siano decorati da piccole protru sioni, le spine dendritiche. B: Segmento di dendrite dal quale emergono spine dendritiche di diversa mor fologia: a fungo (mushro om), tozza (stubby) e sottile (thin).
Fig. 2 Esempi di neuroni della corteccia cerebrale: si possono distinguere i corpi cellulari (asterisco) da cui emerge il dendrite principa le che si ramifica in dendriti secondari. I dendriti siano decorati da piccole protru sioni, le spine dendritiche. B: Segmento di dendrite dal quale emergono spine dendritiche di diversa mor fologia: a fungo (mushro om), tozza (stubby) e sottile (thin).
Utilizzando strumenti ad elevata risoluzione come la microscopia laser confocale e la microscopia elettronica è possibile analizzare l’anatomia fine delle SD e riconoscerne le componenti principali. Come mostrato in Fig. 1A, dopo la marcatura dei neuroni con una sostanza fluorescente le SD rivelano un collo ed una testa, due compartimenti che non hanno dimensioni costanti ma che si presentano con una morfologia molto variabile. Da questa variabilità possono dipendere sia le proprietà elettriche e biochimiche sia lo stato funzionale delle sinapsi. Con la microscopia elettronica è inoltre si possono riconoscere le sub-strutture che compongono i compartimenti sinaptici, una condizione non realizzabile con i microscopi convenzionali. Infatti, con questa tecnica (Fig. 1B) si riconoscono tanto la porzione presinaptica (terminazione assonale) sia le componenti delle SD post-sinaptiche – testa e collo – come pure la densità post-sinaptica (PSD), un complesso proteico dall’aspetto elettrondenso che aderisce alla membrana neuronale.
La PSD è una porzione della sinapsi di estrema importanza perché qui si dispongono alcune molecole fondamentali per la neurotrasmissione (es.: recettori di membrana, molecole di segnalazione, ecc.) che permettono ai neuroni riceventi di comprendere le informazioni che giungono dagli altri neuroni sotto forma del rilascio di un neurotrasmettitore. Risulta quindi chiaro che l’analisi di queste strutture può fornire importanti indicazioni sulla funzionalità e sull’efficacia della connettività sinaptica.
Le SD possiedono proprietà morfologiche che, variando molto dinamicamente, rispecchiano lo stadio di sviluppo (maturazione), la capacità di permanere nel tempo (stabilità) e le proprietà funzionali. I risultati di un numero sempre crescente di studi fanno ritenere che le spine con una morfologia più sottile (thin) (Fig. 2B) ed una testa di dimensioni ridotte, trovate frequentemente a decorare i neuroni degli individui più giovani, rappresentino SD ancora immature, meno stabili nel tempo e con una elevata motilità. Al contrario, quelle più brevi con una morfologia a fungo (mushroom) o più tozza (stubby) (Fig. 2B) dal collo breve ed un’area della testa più estesa sono considerate SD mature, più stabili ed con una motilità ridotta rispetto alle spine sottili. Le tesi più accreditate a riguardo suggeriscono che le SD più sottili siano quelle coinvolte nei fenomeni di apprendimento, e che queste possano eventualmente modificarsi in SD mature (mushroom o stubby) in seguito al potenziamento della connettività sinaptica, ad esempio durante i fenomeni che accompagnano il consolidamento delle tracce mnemoniche.
Alterazioni della densità, delle caratteristiche morfologiche e della motilità delle SD sono state riscontrate nel cervello di pazienti cosi come in quello di modelli murini per diverse patologie neurologiche associate a ritardo mentale tra cui la Sindrome di Rett (RTT). Poiché si ritiene che tali alterazioni siano una causa importante dei difetti nella comunicazione tra neuroni, lo studio degli effetti di una condizione patologica sull’organizzazione morfologica delle sinapsi è fondamentale per comprenderne le conseguenze sulla funzionalità dei circuiti che sottendono facoltà come quelle cognitive e/o motorie. Inoltre, essendo il cervello diviso in aree con caratteristiche cellulari, molecolari e fisiologiche molto diverse tra loro, è importante che la sfida che presenta una tale complessità venga affrontata mediante un approccio che preveda l’analisi approfondita delle diverse aree cerebrali. Una tale strategia è potenzialmente in grado di svelare quali porzioni del sistema nervoso centrale siano più sensibili ad una data mutazione come pure di guidare sia le indagini diagnostiche sia l’efficacia di eventuali tentativi terapeutici prima negli studi pre-clinici sui modelli animali e quindi nell’uomo.
In un articolo recentemente pubblicato sulla rivista “Neural Plasticity” in collaborazione con il gruppo di ricerca del Prof. Lucas Pozzo-Miller dell’Università di Birmingham in Alabama (USA), abbiamo studiato le connessioni neuronali di un modello murino della RTT, in cui il gene Mecp2 è stato inattivato per provocare la patologia. Per i motivi appena descritti, l’analisi è stata rivolta verso la densità e la morfologia delle SD e dei contatti sinaptici in una struttura cerebrale, l’ippocampo, necessaria per i processi cognitivi superiori come ad esempio l’apprendimento e la memoria. Per analizzare la densità delle SD abbiamo utilizzato un approccio chiamato in gergo “DiOlistic” una tecnica che consiste nel colpire preparati istologici di cervello con micro-proiettili di tungsteno ricoperti da un colorante fluorescente. In questo modo è possibile far penetrare il colorante all’interno dei neuroni e visualizzarne l’intera struttura, SD comprese, utilizzando un microscopio confocale (Fig. 3A).
 Fig. 3. A Esempio di neurone ippocampale visualizzato tramite la tecnica del DiOlistic
Fig. 3. A Esempio di neurone ippocampale visualizzato tramite la tecnica del DiOlistic
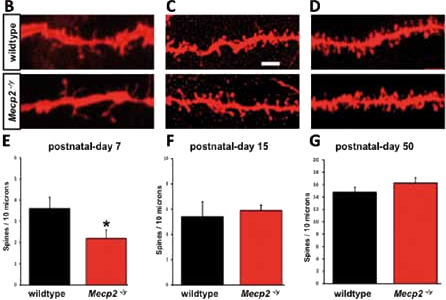 Fig. 3. B-D: Immagini a forte ingrandimento di segmenti dendritici di neuroni ippocampali a diverse età (7, 15 e 50 giorni dopo la nascita) nei topi mutanti per Mecp2 (Mecp2-/y) e nei topi nor mali (wildtype). E-G : Gli istogrammi mostrano i valori della densità delle SD. La densità delle SD è minore nei Mecp2-/y a 7 giorni ma ritorna normale a 15 e 50 giorni.
Fig. 3. B-D: Immagini a forte ingrandimento di segmenti dendritici di neuroni ippocampali a diverse età (7, 15 e 50 giorni dopo la nascita) nei topi mutanti per Mecp2 (Mecp2-/y) e nei topi nor mali (wildtype). E-G : Gli istogrammi mostrano i valori della densità delle SD. La densità delle SD è minore nei Mecp2-/y a 7 giorni ma ritorna normale a 15 e 50 giorni.
Abbiamo deciso di condurre queste analisi su topi di diverse età – di 7 e 15 giorni, quando i topi mutanti per MeCP2 non mostrano sintomi patologici, e di 50 giorni, quando questi manifestano i segni della malattia – per registrare eventuali difetti sinaptici in relazione al progredire della patologia. Abbiamo scoperto che le connessioni sinaptiche degli animali mutanti mostrano segni patologici negli stadi precoci, appena 7 giorni dopo la nascita, alterazioni che potrebbero incidere negativamente sul normale sviluppo delle capacità cognitive. L’analisi complessiva ha mostrato che la densità delle SD ippocampali, che è ridotta nei topi molto giovani, ritorna sorprendentemente a valori normali con il procedere dell’età (15 e 50 giorni) ed il progredire della sintomatologia (Fig. 3B-G). L’analisi delle caratteristiche morfologiche delle SD ha tuttavia mostrato che anche nei mutanti più vecchi sono presenti lievi ma significative alterazioni. Analizzando il numero delle SD, ma questa volta suddividendole nelle 3 classi morfologiche, abbiamo scoperto che a 50 giorni di vita nei topi mutanti per Mecp2 ma non in quelli più giovani il numero di SD con una morfologia thin è irregolarmente ridotto mentre il numero delle spine con una morfologia mushroom o stubby è simile ai topi in cui MeCP2 è normalmente espresso. Una tale anomalia fenotipica delle SD, anche se manifestata in modo lieve come in questo caso, potrebbe determinare alterazioni della comunicazione, della plasticità e delle proprietà computazionali dei neuroni dell’ippocampo nei topi mutanti per MeCP2. In modo importante, le alterazioni sinaptiche indotte dalla mutazione di Mecp2 potrebbero a loro volta provocare gravi deficit di tipo cognitivo.
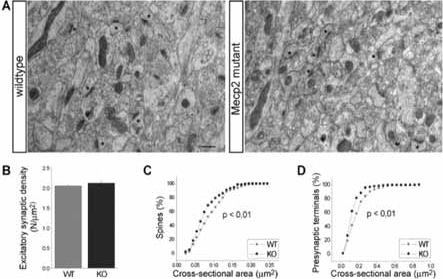 Fig. 4. Analisi delle sinapsi eccitatorie nell’ippocampo di topi mutanti per MeCP2 sintomatici utilizzando la microscopia elettronica. A. Immagini esemplificative dell’ippocampo di topi normali e mutanti acquisite al microscopio elettronico. Alcune sinapsi eccitatorie sono indicate (*). B. Gli istogrammi mostrano la densità delle sinapsi eccitatorie nei tessuti dell’ippocampo in animali Wt e KO. C-D. Analisi quantitativa della testa delle spine dendritiche (C) e delle terminazioni presinaptiche (D) nell’ippocampo di topi mutanti e WT entrambe espresse come percentuale cumulativa delle aree. I topi MeCP2-KO mostrano una diminuzione della dimensione di entrambe le strutture.
Fig. 4. Analisi delle sinapsi eccitatorie nell’ippocampo di topi mutanti per MeCP2 sintomatici utilizzando la microscopia elettronica. A. Immagini esemplificative dell’ippocampo di topi normali e mutanti acquisite al microscopio elettronico. Alcune sinapsi eccitatorie sono indicate (*). B. Gli istogrammi mostrano la densità delle sinapsi eccitatorie nei tessuti dell’ippocampo in animali Wt e KO. C-D. Analisi quantitativa della testa delle spine dendritiche (C) e delle terminazioni presinaptiche (D) nell’ippocampo di topi mutanti e WT entrambe espresse come percentuale cumulativa delle aree. I topi MeCP2-KO mostrano una diminuzione della dimensione di entrambe le strutture.
Per analizzare direttamente il numero e le caratteristiche morfologiche dei contatti fra neuroni abbiamo utilizzato la microscopia elettronica, una tecnica in grado di risolvere strutture di dimensioni inferiori al nanometro (10-6 millimetri) senza ricorrere ad alcuna colorazione istologica. In accordo con i nostri stessi dati ottenuti con l’analisi al microscopio confocale (vedi Fig. 3G) la densità delle sinapsi, calcolata utilizzando metodi stereologici di indagine, è risultata normale nei topi MeCP2-KO (Fig. 4A,B). Misurando le dimensioni delle strutture sinaptiche, abbiamo scoperto che nei topi mutanti a circa 50 giorni di età e con sintomatologia conclamata vi è una significativa diminuzione dell’area sia delle terminazioni presinaptiche sia della testa delle SD (Fig. 4C,D).
Complessivamente, i risultati ottenuti dimostrano che il corretto funzionamento del gene Mecp2 è necessario per la formazione delle SD durante le prime fasi dello sviluppo postnatale, e che un meccanismo di compensazione omeostatico sembra avvenire nei topi mutanti in una fase avanzata della patologia.
Come gia abbiamo già suggerito in un precedente studio (Landi et al., Scientific Reports, 2010), le attuali scoperte sottolineano l’importanza di studiare la patogenesi della RTT durante gli stadi ‘’presintomatici’’ della malattia. Inoltre, negli animali mutanti a 50 giorni di vita anche in assenza di alterazioni del numero di SD sono presenti lievi ma significative alterazioni del loro fenotipo morfologico. Infine, l’analisi ultrastrutturale dei tessuti ha permesso di individuare diffetti strutturali a carico della dimensione delle terminazioni assonali, della testa della spine dendritiche e della relativa lunghezza della PSD. Mentre rimangono da essere chiariti i riflessi funzionali delle alterazioni sinaptiche mostrate dai mutanti a 7 giorni di età, i segni neuropatologici degli animali adulti e sintomatici potrebbero rappresentare un correlato morfologico delle alterazioni funzionali descritta in precedenza a carico della plasticità dei circuiti sinaptici dell’ippocampo (Asaka et al., 2006; Moretti et al., 2006).
Inoltre, l’analisi degli obiettivi raggiunti rimanda alla seguente importante osservazione: i topi mutanti per MeCP2 utilizzati in questo studio sono unanimemente considerati un ottimo modello di studio per la RTT in quanto riproducono fedelmente, per quanto possibile in un modello murino, il quadro sintomatologico della malattia umana (ad es.: la progressione della malattia, i movimenti stereotipati, le ridotte dimensioni dell’encefalo, le difficoltà respiratorie, ecc.). Dal punto di vista citologico, lo studio post-mortem dei tessuti cerebrali prelevati da pazienti di sesso femminile ha mostrato una diminuzione della densità delle SD sia nei circuiti della corteccia che dell’ippocampo rispetto ad individui sani di controllo. I nostri dati sulla densità delle SD dell’ippocampo in topi mutanti maschi nella fase sintomatica non ricapitolano quindi il fenotipo umano osservato su materiale autoptico da pazienti Rett di sesso femminile. Mentre molti fattori che potrebbero contribuire a queste differenze, questi risultati suggeriscono che la densità delle spine dei neuroni dell’ippocampo in questo particolare modello di topo non è un fenotipo con sufficiente validità per la RTT. Infatti, nell’ippocampo dei topi MeCP2 mutanti sembrano intervenire meccanismi di compensazione a livello delle strutture sinaptiche che potrebbero non essere presenti nell’uomo, una differenza di cui sarà necessario tenere in considerazione nella conduzione di futuri studi su questi modelli, nella valutazione dei risultati ottenuti oltre che per la loro comparazione con la situazione dei pazienti. Tuttavia è importante ricordare che questi animali hanno e possono continuare a fornire informazioni preziose sul ruolo di MeCP2 nel SNC. Infatti, modelli animali come questo sono la risorsa sperimentale più efficace al momento disponibile per studiare i meccanismi biologici alla base delle patologie umane come la RTT e per sviluppare nuove terapie. Tale efficacia è tuttavia direttamente proporzionale alle possibilità dei ricercatori di individuare i tratti che si potrebbero discostare dalla condizione umana mediante approfondite ricerche di base i cui risultati devono poi essere necessariamente validate mediante studi in campo clinico.
Riferimento della pubblicazione originale:
Chapleau* CA, Boggio* EM, Calfa G, Percy AK, Giustetto M, PozzoMiller L (2012) Hippocampal CA1 Pyramidal Neurons of Mecp2 Mutant Mice Show a Dendritic Spine Phenotype Only in the Presymptomatic Stage. Neural Plast, 2012:976164. *equal contribution

