Sintesi e implicazioni della pubblicazione: De Felice C, Signorini C, Durand T, Ciccoli L, Leoncini S, D’Esposito M, Filosa S, Oger C, Guy A, Bultel-Poncé V, Galano J-M, Pecorelli A, De Felice L, Valacchi G, and Hayek J, Partial rescue of Rett syndrome by ω-3 polyunsaturated fatty acids (PUFAs) oil. Genes Nutr. (In Press). DOI 10.1007/s12263-012-0285-7 Genes Nutr
Claudio De Felice1 • Cinzia Signorini 2 • Thierry Durand3 • Lucia Ciccoli2 • Silvia Leoncini 2 • Maurizio D’Esposito4,5 • Stefania Filosa 4,5 • Camille Oger 3 •Alexandre Guy3 • Valerie Bultel-Poncé3 • Jean-Marie Galano3 • Alessandra Pecorelli2 • Laura De Felice6 • Giuseppe Valacchi7,8 • Cosimina Cerrone9 • Joussef Hayek9
1Unità di Terapia Intensiva Neonatale, Policlinico “Le Scotte”, AOUS, Siena, Italia; 2Dipartimento di Fisiopatologia, Medicina Sperimentale e Sanità Pubblica, Università degli Studi di Siena, Siena, Italia; 3Institut des Biomolécules Max Mousseron, (IBMM), UMR 5247 CNRS – UMI – UM II , Montpellier, France; 4Istituto di Biofisica e Genetica “Adriano Buzzati Traverso”, CNR, Napoli, Italia; 5IRCSS Neuromed, Pozzilli, Italia; 6Master in Multimedia Content Design, Università di Firenze, Firenze, Italia; 7Dipartimento di Biologia Evolutiva, Università degli Studi di Ferrara, Ferrara, Italia; 8Department of Food and Nutrition, Kyung Hee University, Seoul, Republic of Korea; 9Unità di Neuropsichiatria Infantile, AOUS, Policlinico “Le Scotte” Azienda Ospedaliera Universitaria Senese, Siena, Italia
Lista delle principali abbreviazioni:
AA: ac. Arachidonico; AdA: ac. Adrenico; DHA: ac. Docosaesanoico; EPA: ac. Eicosapentanoico; F2-dihomo-IsoPs: F2-dihomo-Isoprostani; F2-IsoPs: F2-Isoprostani; F3-IsoPs: F3-Isoprostani; F4-IsoPs: F4-Isoprostani; IsoPs: isoprostani; NPBI: Ferro libero non complessato a proteine; PUFA: acidi grassi polinsaturi; ROS: specie reattive dell’ossigeno; RTT: sindrome di Rett.
1) Cosa sono e come agiscono gli acidi grassi polinsaturi (PUFA) ω-3?
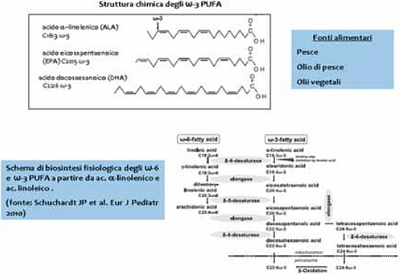
I PUFA ω-3 sono antiossidanti naturali con effetti multipli che presentano un ruolo emergente in varie patologie, comprese varie malattie neuropsichiatriche1. Gli ω-3 (PUFA) sono principalmente prodotti da alghe marine e si concentrano in varie specie ittiche, anche se esistono sorgenti fitobiologiche. In particolare, l’acido eicosapentaenoico (EPA) e l’acido docosaesanoico (DHA) si trovano generalmente nel pesce, olio di pesce e crostacei, mentre l’acido alfa-Linolenico (ALA) è presente nelle noci e negli oli vegetali quali l’olio di lino, di ribes nero e l’olio di colza.
È stato dimostrato che l’attuale dieta occidentale è carente di ω-3 (PUFA) (rapporto ?-6/?-3:15-20/1 invece del raccomandabile 1/1).2-6,7-9 Il meccanismo d’azione degli ω-3 (PUFA) è solo parzialmente conosciuto. Gli ω-3 (PUFA) influenzano la struttura fisico-chimica delle membrane cellulari e modulano l’espressione genica, agiscono sui canali ionici e la biosintesi degli eicosanoidi10-12. EPA e DHA sono fra i principali ω-3 (PUFA) che, oltre a modulare la produzione di prostanoidi attivi e di leucotrieni13, competono con l’acido arachidonico (AA) nella conversione da parte degli enzimi del citocromo P450 con formazione di metaboliti fisiologicamente attivi.14
Schema 1. I principali ω-3 PUFA
2) Perché gli acidi grassi polinsaturi (PUFA) ω-3 nella sindrome di Rett?
I (PUFA) ω-3 sono candidati interessanti nella sindrome di Rett (RTT) per almeno 3 ragioni:
il loro ruolo emergente nella neuro-protezione sia in ambito clinico che sperimentale15;
la loro azione antiossidante multipla16-18 ;
la sicurezza di uso in ambito clinico con scarsi o assenti effetti collaterali riportati.
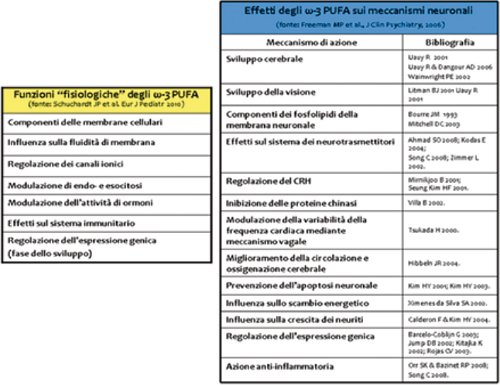 Schema 2. Azioni fisiologiche degli ω-3 PUFA
Schema 2. Azioni fisiologiche degli ω-3 PUFA
3) Perché in 1° stadio?
Nei nostri studi precedenti su pazienti con RTT in stadio avanzato (III-IV) avevamo osservato un miglioramento parziale che si rifletteva in una riduzione significativa della gravità clinica.
Se è vera la nostra ipotesi, secondo la quale meccanismi di stress ossidativo sono in grado di mediare gli effetti della disfunzione MeCP2 nell’espressione del fenotipo clinico, è plausibile che gli stessi meccanismi di stress ossidativo precedano e accompagnino l’insorgenza della sintomatologia clinica nella RTT. In assenza di uno screening clinico in fase pre-sintomatica della RTT abbiamo pensato di focalizzare lo studio degli effetti dei PUFA ω-3 nel primo stadio della malattia secondo il principio generale “The earlier the better”.
Quali ω-3?
Per il presente studio abbiamo utilizzato il Norwegian Fish Oil AS, Trondheim, Norway (Prodotto Numero HO320-6; Distributore italiano: Transforma AS Italia. Forlimpopoli (FC). Italia; Codice di registrazione ministeriale: 10 43863-Y).
Cosa abbiamo trovato?
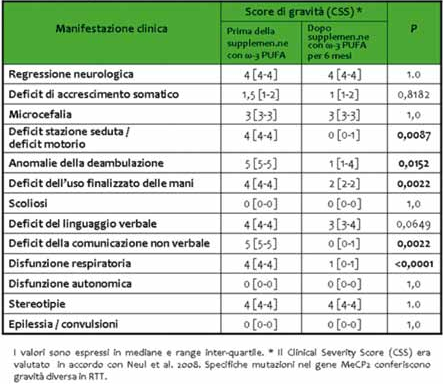
Un totale di 20 pazienti con RTT in primo stadio sono stati randomizzati con supplementazione orale con olio di pesce contenente ω-3 (PUFA)?(DHA: 72,9 ± 8,1 mg/kg al dì; EPA: 117,1 ± 13,1 mg/kg al dì;?ω-3 PUFAs totali: 246,0 ± 27,5 mg/kg al dì) o nessun trattamento. Da questo studio emerge un miglioramento clinico in particolare per quanto riguarda l’area motoria, la comunicazione non verbale e la funzione respiratoria (outcomes primari) (Tabella 1, Figura 1) insieme ad una diminuzione significativa dei livelli di marker di stress ossidativo (outcomes secondari) (Figure 2 e 3) nei pazienti trattati con supplementazione di ω-3 (PUFA).
Tabella 1. Variazioni nella gravità clinica in pazienti RTT in stadio I dopo supplementazione
per 6 mesi con ω-3 PUFA
4) Prospettive
Il presente studio-pilota suggerisce per la prima volta che un intervento “dietetico” per un periodo relativamente breve in una malattia genetica quale la sindrome di Rett in una fase precoce della sua storia naturale è in grado di modificare “almeno parzialmente” Ia biochimica e la clinica della malattia, in assenza di effetti collaterali.
Restano aperte tuttavia le domande sul dosaggio più appropriato, durata del trattamento ed eventuale formulazione chimica e comprensione del ruolo dei metaboliti secondari degli (PUFA)??-3. Finora, per lo meno in Italia, l’uso di questi integratori viene rimborsato fuori nota 13 per prevenzione secondaria nel paziente con pregresso infarto miocardico, ipercolesterolemia poligenica, dislipidemie familiari, iperlipidemie in insufficienza renale cronica o indotte da farmaci. Se i dati del presente studio pilota saranno confermati da trials randomizzati multicentrici controllati è auspicabile che la sindrome di Rett possa diventare un’indicazione specifica alla prescrizione degli (PUFA) ?-3, rimborsabile da parte del SSN.
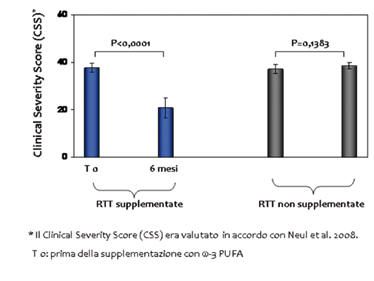 Figura 1. Variazioni nella gravità clinica globale (CSS) in pazienti con sindrome di Rett (RTT) in stadio I in funzione della supplementazione con ω-3 PUFA per 6 mesi
Figura 1. Variazioni nella gravità clinica globale (CSS) in pazienti con sindrome di Rett (RTT) in stadio I in funzione della supplementazione con ω-3 PUFA per 6 mesi
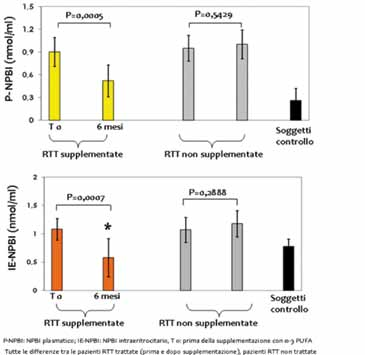 Figura 2. Ferro libero non complessato a proteine (NPBI) in pazienti con sindrome di Rett (RTT) stadio I in funzione della supplementazione con ω-3 PUFA
Figura 2. Ferro libero non complessato a proteine (NPBI) in pazienti con sindrome di Rett (RTT) stadio I in funzione della supplementazione con ω-3 PUFA
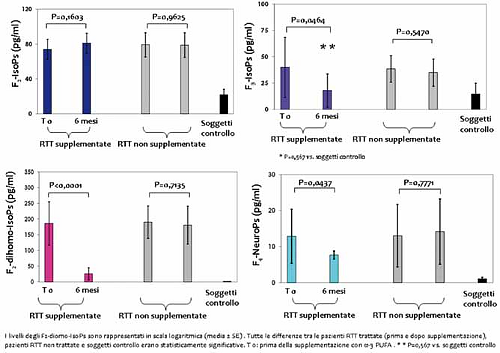 Figura 3. Isoprostani (IsoPs) plasmatici in pazienti RTT in stadio I in funzione della supplementazione con ω-3 PUFA
Figura 3. Isoprostani (IsoPs) plasmatici in pazienti RTT in stadio I in funzione della supplementazione con ω-3 PUFA
Ringraziamenti
Si ringrazia il Kiwanis Club di Siena per il supporto. Inoltre si ringrazia l’AIRETT per il finanziamento del progetto in corso “Alterazione dei meccanismi dello stress ossidativo e loro trattamento in un modello animale della sindrome di Rett” (Responsabili scientifici dott. Maurizio D’Esposito e dott. Joussef Hayek).
BIBLIOGRAFIA SELEZIONATA
McNamara RK (2010) DHA deficiency and prefrontal cortex neuropathology in recurrent affective disorders. J Nutr 140:864–868
Eaton SB, Konner M (1985) Paleolithic nutrition. A consideration of its nature and current implications. New Engl J Med 321:283-289
Simopoulos AP (1999) New products from the agri-food industry: the return of n-3 fatty acids into the food supply. Lipids 34(suppl):S297-S301
Simopoulos AP (1999) Genetic variation and evolutionary aspects of diet. In: Papas A (ed) Antioxidants in nutrition and health. CRC Press. Boca Raton, pp 65-88
Simopoulos AP (1999) Evolutionary aspects of omega-3 fatty acids in the food supply. Prostaglandins Leukotr Essent Fatty Acids 60:421-429
Eaton SB, Eaton SB III, Sinclair AJ, Cordain L, Mann NJ (1998) Dietary intake of long-chain polyunsaturated fatty acids during the Paleolithic. World Rev Nutr Diet 83:12-23
Ledger HP (1968) Body composition as a basis for a comparative of study of some East African animals. Symp Zool Soc Lond 21:289-310
Crawford MA (1968) Fatty acid ratios in free-living and domestic animals. Lancet:1329-1333
Crawford MA, Gale MM, Wooldford MH (1969) Linoleic acid and linolenic acid elongation products in muscle tissue of Syncerus caffer and other ruminant species. Biochem J 115:25-27
Chapkin RS, McMurray DN, Davidso LA, Patil BS, Fan YY, Lupton JR (2008) Bioactive dietary long-chain fatty acids: emerging mechanisms of action. Br J Nutr 100:1152–1157
Jump DB (2002) The biochemistry of n-3 polyunsaturated fatty acids. J Biol Chem 277:8755–8758
Deckelbaum RJ, Worgall TS, Seo T (2006) n-3 fatty acids and gene expression. Am J Clin Nutr 83:1520S–152514.
Schmitz G, Ecker J (2008) The opposing effects of n-3 and n-6 fatty acids. Prog Lipid Res 47:147–155
Arnold C, Markovic M, Blossey K, Wallukat G, Fischer R, Dechend R, Konkel A, von Schacky C, Luft FC, Muller DN, Rothe M, Schunc WH (2010) Arachidonic acid-metabolizing cytochrome P450 enzymes are targets of 3 fatty acids. J Biol Chem285:32720–32733
El-Ansary AK, Al-Daihan SK, El-Gezeery AR (2011) On the protective effect of omega- against propionic acid-induced neurotoxicity in rat pups. Lipids Health Dis 10:142
Lien EL (2009) Toxicology and safety of DHA. Prostaglandins Leukot Essent Fatty Acids 81:125–132
Kris-Etherton PM, Harris WS, Appel LJ; American Heart Association. Nutrition Committee (2002) Fish consumption, fish oil,omega-3 fatty acids, and cardiovascular disease. Circulation 106:2747–2757
Belayev L, Khoutorova L, Atkins KD, Bazan NG (2009) Robust docosahexaenoic acid-mediated neuroprotection in a rat model of transient, focal cerebral ischemia. Stroke 40:3121–3126